Research ▲ TOPへ戻る
研究方針
私たちの身の回りには、医薬品や農薬、染料、機能性製品などたくさんの有機分子であふれています。
これら有機分子の性質や機能をデザインし効率的に合成する研究、すなわち、有機分子のものづくり研究が有機合成化学です。 これまでに数多くの画期的な発見により飛躍的な進展を遂げ、あたかも、あらゆる物質を容易に合成できるかのように感じるかもしれません。
しかし、実際には、分子モデルを組み立てるように分子を自在に合成できるわけではなく、標的分子の構造により非常に長い時間と手間を要することが一般的です。
松本グループでは、有機分子群の効率的かつ短工程合成を目指して、『独自の環境調和型有機合成反応の開発』に取り組みます。
研究内容
医薬品や農薬、機能性材料などには、窒素原子を含む有機化合物が多くあります。
そのため、これら含窒素化合物を効率的に合成する方法論の開発は、創薬研究や材料科学において重要です。
しかし、窒素原子には特有の反応性があるため、これら物質群(アミン類)の化学合成は、通常、容易ではありません。
とくに、アミン類は酸化反応に対して敏感です。
例えば、含窒素化合物の代表であるアニリンを酸化すると、窒素-窒素原子間での結合形成やベンゼン環同士の炭素-炭素連結反応、それ以外にもアゾカップリング反応やポリマー化反応などが進行し、複雑な生成物へと変換されます。
また、これまでのアミン酸化反応では、クロムなど反応性の高い金属酸化剤が汎用されてきましたが、近年、これら重金属反応剤の毒性が問題となっています。
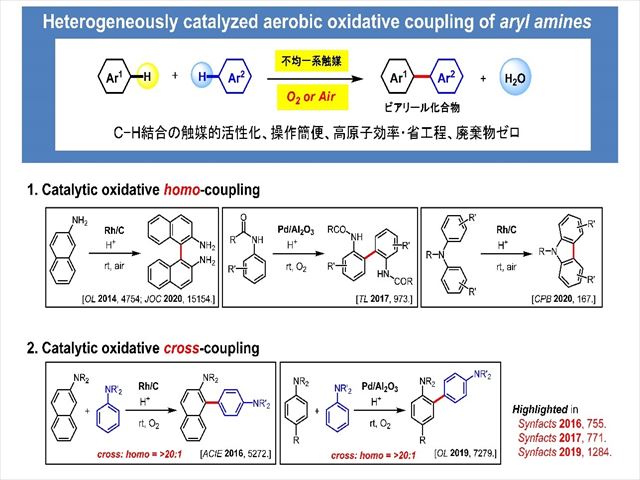
このように位置制御の難しいアミン類の酸化反応ですが、私達は、不均一系酸素酸化触媒を活用することでアミン類の位置選択的酸化法の開発に成功しました。
私たちは、特に、芳香族アミンのベンゼン環同士を直接連結し含窒素ビアリール化合物を与える反応、いわゆる酸化カップリング反応(酸化的ビアリールカップリング反応)の開発に取り組んできました。
上述の方法論を活用し、異種アニリン-アニリン間での高選択的クロスカップリング反応を世界に先駆けて開発するなど、様々な含窒素ビアリール骨格を選択的かつ効率的に合成できることを明らかにしてきました。 また本法では、重金属酸化剤を必要としません。
酸素を酸化剤とするため副生成物として無害な水が生じるのみであることから、『環境にやさしいビアリール合成法』の実現に大きく前進できたと考えています。
アニリン(芳香族アミン)の酸化反応は、とても古典的な有機化学反応です。
当時は、収率も効率も環境への配慮も度外視で、複雑で真っ黒な混合物の中から望みの化合物をわずかでも見つけだそうと奮闘していました。
後に、ここから人工染料の化学工業が始まったのは歴史的にも有名な話です。
さて、ここで話を元に戻すと、私たちは、芳香族アミンの酸化変換を制御し、目的の化合物だけを選択的に化学合成する方法を見出してきました。
しかし、これまでの成果は氷山の一角に過ぎないと考えています。私たちは、これまでの知見を積極的に活用し、さらに新しい酸化的分子変換法の開発に取り組んでいます。
複雑で真っ黒な混合物の中には、私たちのまだ知らない化学、すなわち、お宝がたくさん眠っています。
医薬品や機能性分子の発見を夢見て、一緒に研究しませんか?
