研究内容
糖鎖ナノアジュバントの開発と感染症ワクチン・がん免疫療法への応用
アジュバントとは? —免疫を強化する鍵—
アジュバントは、ワクチンとともに投与され、免疫の働きを強める物質(免疫増強剤)の総称です。
ワクチンに含まれる「抗原」だけでは十分な免疫反応が得られないことが多く、その効果を向上させるために用いられます。
近年では、免疫の働きを調節することで、がんやアレルギーを治療する「免疫療法」にもアジュバントが活用されるようになり、応用範囲が拡大しています。
しかし、現在臨床で使用されているアジュバントの多くは、抗体産生を促進する液性免疫の強化が主な目的であり、ウイルス感染細胞やがん細胞を排除する細胞性免疫を十分に誘導できないという課題があります。
そこで私たちは、自然免疫を活性化するToll様受容体 (TLR) リガンドに注目し、それを選択的かつ効率的に免疫細胞に届ける技術として糖鎖を修飾した金ナノ粒子 (SGNP) を用いた薬物送達システムを確立しました。
この技術を基盤に「糖鎖ナノアジュバント」を開発し、感染症ワクチンやがん免疫療法への応用を目指した研究を進めています。
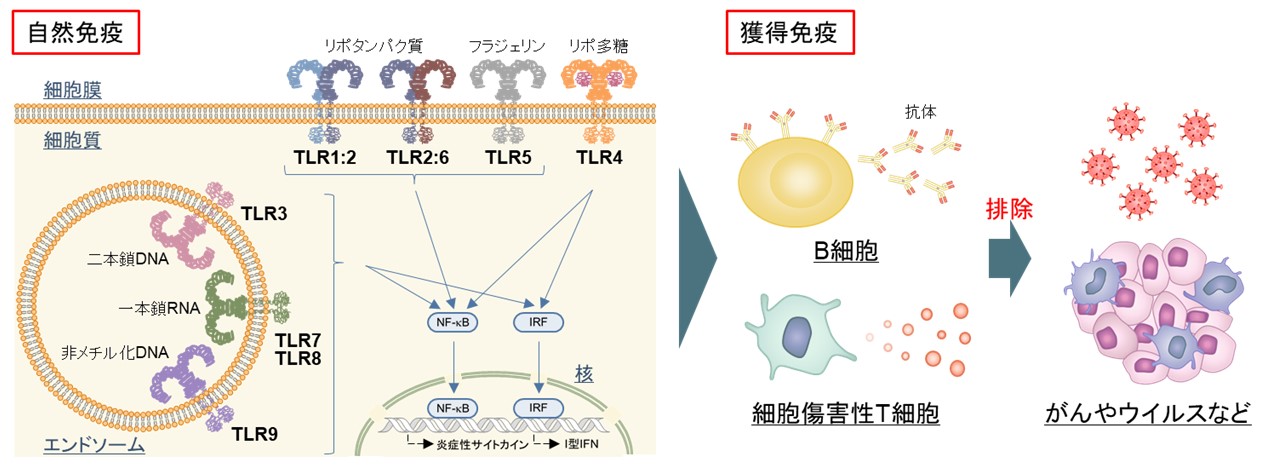
図. TLRが認識する分子とTLRの活性化によって誘導される免疫応答
合成低分子TLR7リガンドを用いた糖鎖ナノアジュバントの開発
TLR7は細胞内のエンドソームに存在し、ウイルスが持つ一本鎖RNAを感知して自然免疫を活性化する受容体です。
TLR7が活性化すると、細胞性免疫の誘導に重要な I 型インターフェロンの産生が促進されるため、多くの合成低分子TLR7リガンドが開発され、ワクチンアジュバントとしての応用が期待されています。
しかし、イミキモド (商品名:ベセルナクリーム) をはじめとする低分子TLR7リガンドは、全身投与するとサイトカイン放出症候群などの重篤な副作用を引き起こすリスクがあり、安全な使用には課題が残っています。
副作用を抑えつつ効果的に免疫を活性化するためには、薬物動態を最適化し、必要投与量を低減する技術が求められます。
そこで私たちは、免疫細胞の表面に発現する糖鎖受容体に着目し、糖鎖修飾金ナノ粒子 (SGNP) をキャリアとする低分子TLR7リガンドの薬物送達システムを開発しました。
この技術により、低分子TLR7リガンドを標的となる免疫細胞へ選択的に輸送することが可能となり、特に細胞性免疫の誘導活性を大幅に向上させることに成功しました。
現在、この技術をウイルス感染症ワクチンやがん免疫療法のアジュバントとして応用する研究を進めています。
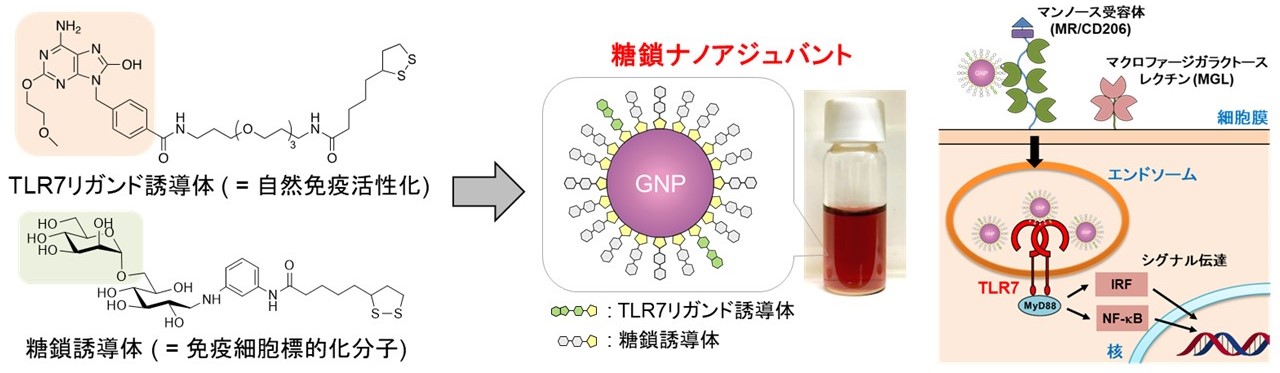
図. TLR7リガンド(1V209)とα-マンノースを固定化した金ナノ粒子
<関連論文>
- Shinchi H., et al., Gold Nanoparticles Coimmobilized with Small Molecule Toll-Like Receptor 7
Ligand and α-Mannose as Adjuvants.
Bioconjugate Chem. 2019, 30(11), 2811-2821.
doi.org/10.1021/acs.bioconjchem.9b00560 - Shinchi H., Yuki Y., et al., Glyco-Nanoadjuvants: Sugar Structures on Carriers of a Small
Molecule TLR7 Ligand Affect Their Immunostimulatory Activities.
ACS Appl. Bio Mater. 2021, 4(3), 2732-2741.
doi.org/10.1021/acsabm.0c01639 - Shinchi H., Komaki F., et al., Glyco-Nanoadjuvants: Impact of Linker Length for Conjugating a
Synthetic Small-Molecule TLR7 Ligand to Glyco-Nanoparticles on Immunostimulatory Effects
ACS Chem. Biol. 2022, 17(4), 957-968.
doi.org/10.1021/acschembio.2c00108